1.Ի՞նչ նյութ է կալցիումի օքսիդը.
Category: Քիմիա
Աղեր:Դասակարգումը:Ստացման եղանակները:Աղերի քիմիական հատկությունները:
Չեզոք աղերը կազմված են մետաղի ատոմներից ու մետաղի ատոմով տեղակալվելու ընդունակ ջրածնի ատոմներ չպարունակող թթվային մնացորդից։
Տարբեր մետաղների չեզոք աղերի օրինակներ՝
| Աղի անվանումը | Աղի բանաձը |
| Նատրիումի նիտրատ | NaNO3 |
| Կալցիումի կարբոնատ | CaCO3 |
| Նիկելի (II) սուլֆատ | NiSO4 |
| Կոբալտի (II) սուլֆատ | CoSO4 |
Թթու աղերը կազմված են մետաղի ատոմներից ու մետաղի ատոմով դեռևս տեղակալվելու ընդունակ ջրածնի ատոմներ պարունակող թթվային մնացորդից։Թթու աղերը բազմահիմն թթուների ոչ լրիվ չեզոքացման արգասիքներն են։
Օրինակ՝
H2SO3+NaOH=NaHSO3+H2O
Թթու աղերն անվանակարգելիս թթվային մնացորդի անվանմանն ավելացվում է «հիդրո» նախածանցը:Որոշ թթու աղերի օրինակներ.
| Աղի անվանումը | Աղի բանաձևը |
| Նատրիումի հիդրոսուլֆատ | NaHSO4 |
| Կալիումի հիդրոֆոսֆատ | K2HPO4 |
| Ամոնիումի երկհիդրոֆոսֆատ | (NH4)H2P O4 |
| Կալցիումի հիդրոկարբոնատ | Ca(HCO3)2 |
Աղերի ստացման եղանակները հիմնված են անօրգանական միացությունների քիմիական հատկությունների վրա:
Աղերի ստացման հիմնական եղանակներն են.
1. հիմքի և թթվի փոխազդեցությունը՝
Ba(OH)2 + 2HCl = BaCl 2+ H2O
2. ալկալու և թթվային օքսիդի փոխազդեցությունը՝
2NaOH + CO2 = Na2SO 3+ H2O
3.ալկալու և լուծելի աղի փոխազդեցությունը (եթե ջրում չլուծվող հիմք է առաջանում)՝
2KOH + CuCl2 = Cu(OH)2↓ + 2KCl
4. հիմնային օքսիդի ու թթվային օքսիդի փոխազդեցությունը՝
MgO + CO2 = MgCO3
5. թթվի ու հիմնային օքսիդի փոխազդեցությունը՝
CuO + 2HCl = CuCl 2+ H2O
6. թթվի ու աղի փոխազդեցությունը, եթե անլուծելի թթու, անլուծելի աղ կամ պակաս ցնդող թթու է առաջանում՝
AgNO3 + HCl = AgCl↓ + HNO3
7.թթվի ու մետաղի փոխազդեցությունը՝
Zn + 2HCl = ZnCl2 + H2↑
8. երկու աղի լուծույթների փոխազդեցությունը, եթե որպես ռեակցիայի արգասիք անլուծելի աղ է առաջանում՝
K2CO 3+ MgSO4 = MgCO3↓ + K2SO4
9. աղի լուծույթի ու մետաղի փոխազդեցությունը, եթե մետաղը ջրի հետ անմիջականորեն չի փոխազդում և մետաղների համեմատական ակտիվության շարքում աղի բաղադրությունում առկա մետաղի համեմատ ձախ է տեղադրված՝
Zn+CuSO4=ZnCl2+CuCu+2AgNO3=Cu(NO3)+2Ag
10. մետաղի ու ոչ մետաղի փոխազդեցությունը՝
Ca + S = CaSZn+Br2=ZnBr2
Աղերի քիմիական հատկությունը
Աղերը փոխազդում են՝
1. Մետաղների հետ:
Աղերի ու մետաղների փոխազդեցությունը սովորաբար հանգեցնում է աղի ու մետաղի առաջացման (տեղակալման ռեակցիա)։ Փոխազդող նյութերն ընտրվում են ըստ մետաղների համեմատական ակտիվության շարքի։ Ընդ որում` յուրաքանչյուր մետաղ դուրս է մղում իրեն հաջորդող բոլոր մետաղները դրանց աղերի լուծույթներից։
Օրինակ՝
Fe + CuSO 4= FeSO 4+ Cu
2. Հիմքերի հետ:
Այս փոխազդեցությունը հանգեցնում է նոր հիմքի և նոր աղի առաջացման (հիշեցնենք, որ ելանյութ աղը պետք է ջրում լուծելի լինի, իսկ արգասիքների թվում կա՛մ անլուծելի հիմք, կա՛մ անլուծելի աղ լինի):
Օրինակ՝
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
3. Թթուների հետ:
Այս փոխազդեցությունը հանգեցնում է նոր թթվի և նոր աղի առաջացման (ելանյութերն անհրաժեշտ է ընտրել այնպես, որ արգասիքների թվում անլուծելի, կամ թույլ, կամ անկայուն թթու, կամ էլ անլուծելի աղ լինի)։
Օրինակ՝
BaCl 2+ H2SO4 = BaSO4↓ + 2HCl
4. Աղերի հետ:
Այս փոխազդեցությունը հանգեցնում է երկու նոր աղի առաջացման։ Փոխազդող նյութերը պետք է այնպես ընտրել, որ ելանյութերը ջրում լուծելի լինեն, իսկ արգասիքներից գոնե մեկն անլուծելի լինի:
Օրինակ՝
CuSO4 + Ba(NO3 )2= 2BaSO4↓ + Cu(NO3)2
5. Ոչ մետաղների հետ:
Այսպիսի փոխազդեցությունը բնորոշ է հալոգեններին (VII Ա խմբի տարրեր), հանգեցնում է աղի ու ոչ մետաղի առաջացման (տեղակալման ռեակցիա), ընդ որում` յուրաքանչյուր հալոգեն դուրս է մղում պակաս ակտիվ հալոգենը վերջինիս աղի լուծույթից:
Օրինակ՝
2KBr + Cl2 = 2KCl + Br2
Թթուներ:Դասակարգումը:Ստացման եղանակները:ԹԹունների քիմիական հատկությունները:
Թթուները բարդ նյութեր են, որոնց մոլեկուլները կազմված են մեկ կամ մի քանի ջրածնի ատոմներից և թթվային մնացորդից:
Բոլոր թթուների ջրային լուծույթները թթու համ ունեն և դրանք օժտված են նույնանման հատկություններով՝ իրենց բաղադրիչ տարրի՝ ջրածնի շնորհիվ:
Ոչ բոլոր թթուների լուծույթները կարելի է համտեսել. դրանց մեջ հանդիպում են հյուսվածքներ քայքայողներ, նույնիսկ թունավորներ:
Մրջունները «թշնամիներից» պաշտպանվելու նպատակով արտաթորում են մրջնաթթվի կծու կաթիլներ:

Այս նույն թթուն արկա է եղինջի տերևների «խայթող» մազիկներում:

Ցանկացած թթվի մոլեկուլի բաղադրությունը, անկախ ծագումից (օրգանական, կամ հանքային), արտահայտվում է հետևյալ ընդհանուր բանաձևով՝ HnR , որտեղ R-ը թթվային մնացորդն է, n-ը՝ ջրածնի ատոմների թիվը:
Թթվային մնացորդներն ունեն որոշակի բաղադրություն և վալենտականություն, վերջինս որոշվում է ըստ մետաղներով տեղակալվելու ընդունակ ջրածնի ատոմների թվի:Որոշ հանքային թթուների և թթվային մնացորդների անվանումները
Թթուները մեծ տարածվածություն ունեն բնության մեջ: Օրինակ՝ կիտրոնում պարունակվում է կիտրոնաթթու, խնձորի մեջ՝ խնձորաթթու, թրթնջուկի տերևներում՝ թրթնջկաթթու:
Թթուների ստացման եղանակները
Անթթվածին թթուները ստացվում են համապատասխան գազային ջրածնային միացությունները ջրում լուծելով, իսկ գազային ջրածնային միացությունները ստացվում են
ա) ջրածնի և համապատասխան ոչ մետաղի անմիջական փոխազդեցությունից.
H2+F2=2HF
H2+Br2=2HBr
H2+S=H2S
H2+Cl2=2HCl
բ) համապատասխան աղի և մեկ այլ` ավելի ուժեղ թթվի փոխազդեցությունից.
FeS+H2SO4=FeSO4+H2S↑
NaCl(պինդ) +H2SO4(խիտ) =NaHSO4+HCl↑ (լաբորատորեղանակ)
2NaCl(պինդ) +H2SO4(խիտ) =Na2SO4+2HCl↑ (արդյունաբերականեղանակ)
գ) որոշ այլ փոխազդեցություններից։
Օրինակ՝ ավելի ակտիվ ոչ մետաղները դուրս են մղում պակաս ակտիվները
համապատասխան թթուներից.
2HJ + Br2 = 2HBr + J2
H2S + Cl2 = 2HCl + SH2
S + Cl2 = 2HCl + S
Թթվածնային թթուների ստացման հիմնական եղանակ (համապատասխան օքսիդի ու ջրի փոխազդեցությունն արդեն նշվել է «Ջրածին» և «Օքսիդներ» թեմաներում):
Թթվածնային թթու է ստացվում նաև այդ թթվի աղի և այլ թթվի փոխազդեցությունից,
եթե.
ա) ստացվող թթուն, փոխազդող թթվի համեմատ` ցնդող է.
NaNO3 + H2SO4 = NaHSO4 + HNO3
բ) որպես ռեակցիայի արգասիք՝ ջրում անլուծելի աղ կամ թթու է առաջանում.
Na2SiO 3+ 2HNO3 = H2SiO3↓ + 2NaNO3
Թթուների քիմիական հատկությունները
Թթուների որոշ քիմիական հատկություններին (փոխազդեցությունը մետաղների ու մետաղների օքսիդների հետ) հանգամանորեն անդրադարձել ենք «Ջրածին» և «Թթվածին» թեմաներում։ Ուստի այստեղ կներկայացնենք թթուներին բնորոշ այլ հատկությունները:
1.Թթուների փոխազդեցությունը հայտանյութերի հետ.Բոլոր թթուների ջրային լուծույթները գունավորում են հայտանյութեր՝
լակմուսը` կարմիր, մեթիլօրանժը` մուգ վարդագույն, իսկ ֆենոլֆտալեինը թթուներում չի գունավորվում:
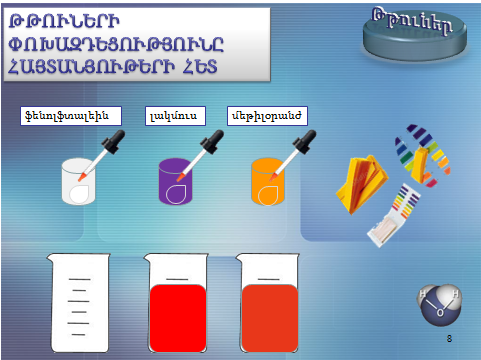
2.Թթուների և հիմքերի փոխազդեցությունը
Թթուներին առավել բնորոշ է հիմքերի (ինչպես ալկալիների, այնպես էլ` ջրում չլուծվող) հետ փոխազդեցությունը` չեզոքացման ռեակցիան, որի հետևանքով առաջանում է աղ և ջուր.
LiOH + HCl = LiCl + H2O
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
3.Թթուների և աղերի փոխազդեցությունը
Նման ռեակցիա իրականացնելու համար անհրաժեշտ է ելանյութերն ընտրել այնպես, որ արգասիքների թվում լինի.
ա) անլուծելի թթու.
H2SO 4+ Na2SiO3= Na2SO4 + H2SiO3↓
բ) թույլ թթու.
CH3COOK + HBr = CH3COOH + KBr
գ) անկայուն թթու.
K2CO3 + 2HBr = 2KBr + CO2↑ + H2O
դ) անլուծելի աղ.
AgNO3 + HBr = AgBr↓ + HNO3
4. Որոշ թթուներ տաքացնելիս քայքայվում են.
H2SiO3= SiO2 +H2O
H2SO3= SO2 +H2O
Չեզոքացման ռեակցիա, չեզոքացում, թթվի հատկություններ ունեցող նյութերի և հիմքի հատկություններ ունեցող նյութերի միջև ընթացող քիմիական ռեակցիա, որի հետևանքով այդ նյութերը կորցնում են թթուներին ու հիմքերին բնորոշ հատկությունները։
Պատասխանել հարցերին
- Որոշե՛ք թթու առաջացնող տարրերի օքսիդացման աստիճանը հետևյալ թթուններում.
HNO3, H2SiO3 ,HNO3 , HCIO4 , H3PO4 - Ո՞ր ռեակցիաներն են անվանվում չեզոքացման :
- Գրե՛ք հետևյալ փոխարկումներին համապատասխանող քիմիական ռեակցիաների հավասարումները.
S- SO2-SO3-H2SO4— BaSO4
Ամփոփիչ աշխատանք
- Որոշե՛ք տարրեի զագվածային բաժինը մանգանի (VII) օքսիդում:
Mn-54,9 - Ի՞նչ նյութեր են ստացվում N205, BaO Li2O օքսիդների և ջրի փոխազդեցությունից:
N2O5-2NO2+O3=N2O5+O2″
BaO-Ba+O2=BaO+CO2″
Li2O-4Li+O2=2Li2O - Ի՞նչ եք հասկանում տարրի օքսիդացման աստիճան ասելով:
Տարրի օքսիդացման աստիճանը պայմանական այն լիցքն է, որը քիմիական միացության մոլեկուլում վերագրվում է ատոմին ենթադրելով, թե միացությունը կազմված է միայն իոններից: - Ինչպե՞ս է գրառվում օքսիդացման աստիճանը:
Օքսիդացման աստիճանը գրառվում է արաբական թվանշանով, դրվում է քիմիական նշանի վերևում, սկզբից գրվում է + կամ –, ապա լիցքի թվային արժեքը: - Թվարկե ՛ք հաստատուն օքսիդացման աստիճան ունեցող տարրերը:
Թթվածին, նատրիում, ֆտոր, ալյումինիում, ծծումբ, ցինկ, ածխածին, ջրածին - Որքա՞ն է թթվածնի վալենտականությունը և օքսիդացման աստիճանը թթվածնի պարզ նյությում:
Վալենտականությունը երկվալենտ է
Օքսիդացման աստիճանը -2 - Որքա՞ն է 1 ատոմ ծծմբի զանգվածը (գ).
1) 16
2) 32
3) 5,312*10-23
4) 1,66*10-27 - Ինչի՞ է հավասար երկաթի կոլչեդանի (FeS2) հարաբերական մոլեկուլային զանգվածը.
120 - Տրված միացություններից՝ MgSO4, CaSO4, BaSO4, SrSO4, որո՞ւմ է ծծմբի զանգվածային բաժինն ամենամեծը.
MgSO4 - Որոշե՛լ օքսիդացման աստիճանը միացությունում գտնվող տարրերի.
ա. CuO
բ. NaOH
գ. LiH
դ. SiO2
Օքսիդների քիմիական հատկությունները
Հիմնային օքսիդների քիմիական հատկությունները
1. Ալկալիական և հողալկալիական մետաղների օքսիդները փոխազդում են ջրի հետ՝ առաջացնելով ջրում լուծվող հիմքեր՝ ալկալիներ:
Հիմնային օքսիդ + ջուր →հիդրօքսիդ
Օրինակ
Կալցիումի օքսիդի և ջրի փոխազդեցությունից առաջանում է կալցիումի հիդրօքսիդ:
CaO+H2O→Ca(OH)2
2. Հիմնային օքսիդները փոխազդում են թթուների հետ՝ առաջացնելով աղ և ջուր
Հիմնային օքսիդ + թթու → աղ + ջուր
CuO+H2SO4→CuSO4+H2O
3. Հիմնային օքսիդները կարող են փոխազդել այլ տեսակի (թթվային և երկդիմի) օքսիդների հետ՝ առաջացնելով աղեր:
Հիմնային օքսիդ + թթվային օքսիդ →աղ
Հիմնային օքսիդ + թթվային օքսիդ →աղ
Օրինակ
Մագնեզիումի օքսիդը փոխազդելով ածխածնի (IV) օքսիդի հետ՝ առաջացնում է մագնեզիումի կարբոնատ:
MgO+CO2→MgCO3
Թթվային օքսիդների քիմիական հատկությունները
1. Թթվային օքսիդները փոխազդում են ջրի հետ` առաջացնելով թթու:
Թթվային օքսիդ + ջուր → թթու
Օրինակ
Ծծմբի (VI) օքսիդը փոխազդում է ջրի հետ՝ առաջացնելով ծծմբական թթու:
SO3+H2O→H2SO4
2. Թթվային օքսիդները փոխազդում են ալկալիների հետ՝ առաջացնելով աղ և ջուր:
Թթվային օքսիդ + հիմք → աղ + ջուր
Օրինակ
Ծծմբի (IV) օքսիդը, փոխազդելով նատրիումի հիդրօքսիդի հետ,՝առաջացնում է նատրիումի սուլֆատ և ջուր:
SO2+2NaOH→Na2SO3+H2O
3. Թթվային օքսիդները փոխազդում են հիմնային օքսիդների հետ՝ առաջացնելով աղեր:
Թթվային օքսիդ +հիմնային օքսիդ →աղ
Օրինակ
Ածխածնի (IV) օքսիդը փոխազդելով կալցիումի օքսիդի հետ՝ առաջացնում է կալցիումի կարբոնատ:
CO2+CaO→CaCO3
Երկդիմի (ամֆոտեր) օքսիդների քիմիական հատկությունները
1.Երկդիմի օքսիդները փոխազդելով թթուների կամ թթվային օքսիդների հետ ցուցաբերում են հիմնային օքսիդներին բնորոշ (հիմնային) հատկություններ:
Օրինակ
Ցինկի օքսիդի և աղղաթթվի փոխազդեցությունից առաջանում է ցինկի քլորիդ և ջուր:
ZnO+2HCl→ZnCl2+H2O
Իսկ ալյումինի օքսիդի և ազոտի (V) օքսիդի փոխազդեցությունից առաջանում է ալյումինի նիտրատ՝
Al2O3+3N2O5=2Al(NO3)3
2. Երկդիմի օքսիդները՝ փոխազդելով ալկալիների կամ ալկալիական և հողալկալիական մետաղների օքսիդների հետ, ցուցաբերում են թթվային հատկություններ:
Երկդիմի օքսիդների և ալկալիների համահալումից ընթանում է քիմիական ռեակցիա, որի հետևանքով առաջանում է աղ և ջուր:
Օրինակ
Ցինկի օքսիդի և կալիումի հիդրօքսիդի համահալումից առաջանում է կալիումի ցինկատ և ջուր:
ZnO+2KOH→K2ZnO2+H2O
Եթե ալյումինի օքսիդը համահալել նատրիումի հիդրօքսիդի հետ, ապա կառաջանա նատրիումի ալյումինատ և ջուր՝
Al2O3+2NaOH→2NaAlO2+H2O
Բերիլիումի օքսիդի և կալիումի օքսիդի փոխազդեցությունից առաջանում է նատրիումի բերիլատ՝
BeO+Na2O=Na2BeO2
Պատասխանել հարցերին
- Որոշե՛ք տարրեի զագվածային բաժինը մանգանի (VII) օքսիդում:
Mn-54,9 - Ի՞նչ նյութեր են ստացվում N205, BaO Li2O օքսիդների և ջրի փոխազդեցությունից:
N2O5-2NO2+O3=N2O5+O2″
BaO-Ba+O2=BaO+CO2″
Li2O-4Li+O2=2Li2O
Օքսիդներ :Դասկարգումը :Ստացման եղանակները:
Մոլեկուլում -2 օքսիդացման աստիճանով թթվածնի ատոմ պարունակող երկտարր այն միացությունները, որոնցում թթվածնի ատոմներն անմիջականորեն միացած են մեկ այլ տարրի ատոմների հետ, իսկ միմյանց հետ միացած չեն, անվանվում են օքսիդներ:
Օքսիդները դասակարգվում են ըստ քիմիական հատկությունների.
1.Հիմնային օքսիդներ՝ Na2O,CaO,CuO,FeO,MnO,Cu2O և այլն:
Հիմնային են կոչվում այն օքսիդները, որոնց համապատասխանող հիդրատները հիմքեր են:
Na2O⇒NaOH,CaO⇒Ca(OH)2
Եթե օքսիդ առաջացնող տարրը ալկալիական կամ հողալկալիական մետաղ է կամ այլ մետաղ է, որը ցուցաբերում է այդ օքսիդում նվազագույն վալենտականություն (I,II),ապա օքսիդը որպես կանոն հիմնային է:

նատրիումի օքսիդ՝ Na2O

կալցիումի օքսիդ՝ CaO

պղնձի (I) օքսիդ՝ Cu2O

պղնձի (II) օքսիդ՝ CuO

մանգանի (II) օքսիդ՝ MnO
2. Թթվային օքսիդներ՝P2O5,N2O5,Mn2O7,CrO3,CO2, և ալն:
Թթվային են կոչվում այն օքսիդները, որոնց համապատասխանող հիդրատները թթուներ են:
SO2⇒H2SO3,N2O5⇒HNO3
Եթե օքսիդ առաջացնող տարրը ոչ մետաղ է, ապա այդ օքսիդը հիմնականում՝ թթվային է:
Եթե օքսիդ առաջացնող տարրի ատոմը ցուցաբերում է մետաղական հատկություն և առավելագույն վալենտականություն (V-VIII), ապա oքսիդը թթվային է:

ֆոսֆորի (V) օքսիդ՝ P2O5

քրոմի (VI) օքսիդ՝ CrO3
3.Երկդիմի (ամֆոտեր) օքսիդներ՝ BeO,ZnO,Al2O3,Cr2O3 և այլն:
Նյութերը, որոնք ցուցաբերում են և թթվային, և հիմնային հատկություններ, մանվանվում են երկդիմի (ամֆոտեր):
Եթե օքսիդ առաջացնող տարրը ցուցաբերում է մետաղական հատկություններ և բարձր վալենտականություն (III, IV), ապա օքսիդը երկդիմի է:

ալյումինի օքսիդ՝ Al2O3

ցինկի օքսիդ՝ ZnO
4.Անտարբեր (աղ չառաջացնող) օքսիդներ` N2O,NO,CO,SiO և այլն:
Ոչ մետաղների օքսիդները, որոնք թթուների ու հիմքերի հետ սովորական պայմաններում չեն փոխազդում, կոչվում են անտարբեր օքսիդներ:
Օքսիդների ստացման եղանակները
Օքսիդներն ստացվում են.
1. թթվածնի հետ պարզ և բարդ նյութերի փոխազդեցությունից (հիմնականում`տաքացնելիս).
C+Օ2=CO2
4Al+3O2=2Al2O3
2ZnS+3O2=2ZnO+2SO2
2. թթվածին պարունակող որոշ բարդ նյութերի՝ տաքացման պայմաններում քայքայվելիս.
Mg(OH)2=MgO+H2O
CaCO3=CaO+CO2
H2SiO3=SiO2+H2O
3.աղի ու թթվի փոխազդեցությունից.
Na2CO3 + H2SO4 = Na2SO4+ CO2↑ + H2O
K2SO3 + 2HCl = 2KCl + SO2↑ + H2O
Թթուների փոխազդեցությունը մետաղների և մետաղների օքսիդների հետ:Աղեր
Թթուների (ջրային լուծույթներում) և մետաղների միջև ընթացող քիմիական ռեակցիաների հավասարումներ կազմելիս պետք է ղեկավարվել մետաղների համեմատական ակտիվության շարքով (Բեկետովի շարք): Դրանում ջրածնից առաջ (ձախ) տեղադրված մետաղները ջրածինն արտամղում են թթուների ջրային լուծույթներից (բացառություն են ազոտական և խիտ ծծմբական թթուները): Յուրաքանչյուր մետաղ իրենից աջ (հետո) մետաղներից ավելի ակտիվ է:
Օրինակ՝
Mg+2HCl=MgCl2 մագնեզիումի քլորիդ+H2
Zn+H2SO4(Նոսր)=ZnSO4 ցինկի սուլֆատ +H2
Cu+HCl≠
Ag+H2SO4(Նոսր)≠
Մագնեզիում և ցինկ մետաղները տեղադրված են ջրածնից ձախ, իսկ պղինձը և արծաթը՝ աջ:
Թթուների ու մետաղների փոխազդեցությունից (մագնեզիումի քլորիդ, ցինկի սուլֆատ) առաջանում է աղ և անջատվում՝ ջրածին:
Աղերը բարդ նյութեր են՝ կազմված մետաղի ատոմներից և թթվային մնացորդներից:Թթվային մնացորդներն ունեն որոշակի բաղադրություն և վալենտականություն:
Վերը նշված ռեակցիաների հետևանքով առաջացած աղերի բաղադրությունը՝ MgCl2-ը, կազմված է մագնեզիում մետաղի ատոմից և քլորաջրածնական (աղաթթվի) Cl−
թթվային մնացորդից: MgCl2-ը անթթվածին թթվի աղ է (կարդացվում է մագնեզիումի քլորիդ)
ZnSO4-ը կազմված է ցինկ մետաղի ատոմից և ծծմբական թթվի SO2−4 թթվային մնացորդից: ZnSO4 թթվածնավոր թթվի աղ է (կարդացվում է ցինկի սուլֆատ):Աղերն անվանելու համար մետաղի անվանմանը (սեռական հոլովով) ավելացնում են համապատասխան թթվի թթվային մնացորդի անվանումը՝ ուղղական հոլովով:
Եթե մետաղն օժտված է փոփոխական օքսիդացման աստիճանով, ապա աղի անունը գրելիս մետաղի վալենտականությունը հռոմեական թվերով նշում են մետաղի անունից անմիջապես հետո:
Օրինակ՝
Fe2+(SO4)2−երկաթի (II) սուլֆատ (կարդացվում է երկաթի երկու սուլֆատ)
Fe3+2(SO4)32−երկաթի (III) սուլֆատ (կարդացվում է երկաթի երեք սուլֆատ)
Թթուների ու մետաղների oքսիդների փոխազդեցությունը
Մետաղների օքսիդները թթուների հետ փոխազդելիս աղ և ջուր են առաջացնում:
Օրինակներ՝
MgO+2HCl=MgCl2մագնեզիումիքլորիդ+H2O
ZnO+H2SO4=ZnSO4ցինկիսուլֆատ+H2O



Պատասխանել հարցերին
- Կազմե ՛ք ցինկի ,նատրիումի ,երկաթի(III) ծծմբաթթվական աղերի բանաձևերը:
- Ո՞րն է թթուների և աղերի նմանությունն ըստ բաղադրության:
- Գրե ՛ք հետևյալ աղերի բանաձևերը.
ա. ցինկի քլորիդ բ.մագնեզիումի բրոմիդ, գ.երկաթի(III) յոդիդ
դ.ալյումինի յոդիդ, ե.երկաթի (II) ֆտորիդ զ.պղնձի(II) սուլֆիդ
Ամփոփիչ աշխատանք
- Ի՞նչ եք հասկանում վալենտականություն ասելով:
Վալենտականությունը քիմիական տարրի` որոշակի թվով ընդհանրացվող էլեկտրոնային զույգեր առաջացնելու հատկությունն է։
- Միացությունում ո՞ր տարրի վալենտականությունը չի համապատասխանում խմբի համարին:
ա.F բ.S գ.O դ.Ne ե.Cl - Որոշե՛ք տարրերի վալենտականությունը հետևյալ բանաձևերում՝
CO2 SiO2 N2O3 N2O5 Cl2O
CO2=(C=2),(O=2)
SiO=(Si=4),(O=2)
N2O3=(N=2),(O=3)
N2O5=(N=2),(O=5)
CI2O=(CI=2),(O=1)
- Որքա՞ն է 8գ զանգվածով ջրածնի ա.նյութաքանակը(մոլ) բ.ծավալը ։
m (H) = 8գ
Ar (H2) = 2
V (նյու) = m/Ar = 8/2 = 4 (մոլ)
բ. ծավալ
V (ծավալ) = m * Vm /M = 8 * 22,4 /2 = 89,6
- Որքա՞ն է ջրածնի զանգվածային բաժինը (%) էթիլսպիրտում `(C2H5OH)
Advertisements
about:blank
REPORT THIS AD
Mr (C2H5OH) = 24 + 6 + 16 = 46
ω (օմեգա) (H) = 6/46 * 100 = 13%
- Հաշվել ածխածնի օքսիդի (CO2),հարաբերական մոլեկուլային զանգվածը:
Mr(CO2)2Ar(C)+Ar(O)=2+12+16=30
- Որքա՞ն է 0.75 մոլ թթվածնի (O2) զանգվածը(գ):
Mr(O2)=16*2=32գ
m=M*n=32*0.75=24գ
- Որքա՞ն է 106,5 գ զանգվածով ֆոսֆորի օքսիդի նյութաքանակը(մոլ):
m=106,5 գ
Mr(P2O5)=31*2+16*5=62+80=142գ
n=m/Mr=106,5/142=0.75մոլ
- Հետևյալ ռեակցիաների ուրվագրերում ընտրեք գործակիցները
- ա. Fe + O2 = Fe3O
- 3Fe+2O2=Fe3O4
բ. Al + HCl =AlCl3 + H2 - Հաշվել 3 մոլ ծծմբական թթվի(H2SO4) զանգվածը(գ):
Mr(H2SO4)=1*2=2*480=960գ
m=M*n=960*3=2880գ
- Գործակիցներն ընտրելուց հետո ռեակցիաների հավասարումներում նշեք ռեակցիային մասնակցող յուրաքանչյուր նյութի քանակը (մոլ)
2Al + 3Cl2 = 2Al Cl3 2 մոլAl 3մոլ Cl 2մոլ AlCl
ա.CO2 + NaOH=Na2CO3+H2O=CO 2մոլ,Na 2մոլ,CO 3մոլ,H 2մոլ,O 1մոլ:
բ.Al+CuSO4=Al2(SO4)3+Cu=AI 2մոլ,Cu 1մոլ,SO 4մոլ:
Մարտի 13֊17
Դասի թեման`Ջրածին։Քիմիական տարր և ապարզ նյութ։Ջրածինը բնության մեջ։
Ջրածինը (Hydrogenium` լատիներեն ջուր ծնող) պարբերական համակարգի առաջին պարբերության՝ առաջին խմբի, մեկ կարգաթվով տարրն է:

Ջրածնի ատոմն ունի ամենապարզ կառուցվածքը` մեկ դրական լիցքով միջուկի շուրջը սփռված է մեկ էլեկտրոն:Միացություններ առաջացնելիս ջրածինը հիմնականում ցուցաբերում է մետաղական հատկություն, այսինքն՝ տալիս է մեկ էլեկտրոն և ձեռք է բերում +1 լիցք:
H0−1e→H+
Իսկ որոշ պայմաններում ոչ մետաղական հատկություն` ընդունում է էլեկտրոն (օրինակ՝ մետաղների հետ առաջացած միացություններում) և ձեռք բերում −1 օքսիդացման աստիճան:
H0+1e−→−H−
Միացությունների ձևով ջրածինը չափազանց տարածված տարր է: Նա կազմում է ջրի զանգվածի 11 %-ը, մտնում է բոլոր բուսական` մրգերի, բանջարեղենների, թթուների, և կենդանական նյութերի` ճարպերի, սպիտակուցների, ածխաջրերի, նավթի, և շատ այլ հանքային նյութերի բաղադրության մեջ:
Նա կազմում է արեգակի և աստղերից շատերի զանգվածի կեսից ավելին: Արեգակնային համակարգի ամենամեծ մոլորակը` Յուպիտերը, համարյա լրիվ կազմված է ջրածին քիմիական տարրից: Ցածր ջերմաստիճանի և շատ բարձր ճնշման պատճառով ջրածինն այդ մոլորակի վրա գտնվում է պինդ վիճակում:Ջրածին տարր պարունակող ցանկացած միացություն պարունակում է ջրածնի երկու իզոտոպ` պրոտիում ( 99,98) և դեյտերիում (0,02): Աննշան քանակությամբ հանդիպում է նաև երրորդ իզոտոպը` տրիտիումը:

Ջրածնի մոլեկուլի բանաձևն է՝ H2, հարաբերական մոլեկուլային զանգվածը՝ 2,016 (կլորացված 2), մոլային զանգվածը՝ 2 գ/մոլ՝

Ջրածինը բնության մեջ ազատ վիճակում հանդիպում է չնչին քանակով՝ գլխավորապես մթնոլորտի վերին շերտերում: Երբեմն, այն երկրի ընդերքից դուրս է գալիս այլ գազերի հետ հրաբխային ժայթքումների, ինչպես նաև նավթի արդյունահանման ժամանակ:
Պատասխանել հարցերին
- Որքա՞ն է 8գ զանգվածով ջրածնի ա.նյութաքանակը(մոլ) բ.ծավալը ։
ա. նյութաքանակ (մոլ)
m (H) = 8գ
Ar (H2) = 2
V (նյու) = m/Ar = 8/2 = 4 (մոլ)
բ. ծավալ
V (ծավալ) = m * Vm /M = 8 * 22,4 /2 = 89,6 - Որքա՞ն է ջրածնի զանգվածային բաժինը (%) էթիլսպիրտում `(C2H5OH)
Mr (C2H5OH) = 24 + 6 + 16 = 46
ω (օմեգա) (H) = 6/46 * 100 = 13%
Մարտի 6-10
Մետաղների օքսիդներում թթվածին տարրի ատոմը (ատոմները) միացած է մետաղ տարրի ատոմի (ատոմների) հետ:
Օրինակ՝ CuO,MgO,ZnO,Na2O,Cr2O3 և այլն:
Մետաղների օքսիդները սովորական պայմաններում պինդ նյութեր են:Մետաղների օքսիդները, որոնց համապատասխանում են հիմքեր, անվանում են հիմնային օքսիդներ:
Մոլեկուլում -2 օքսիդացման աստիճանով թթվածնի ատոմ պարունակող երկտարր այն միացությունները, որոնցում թթվածնի ատոմներն անմիջականորեն միացած են մեկ այլ տարրի ատոմների հետ, իսկ միմյանց հետ միացած չեն, անվանվում են օքսիդներ:
Օքսիդները դասակարգվում են ըստ քիմիական հատկությունների.
.Հիմնային օքսիդներ՝ Na2O,CaO,CuO,FeO,MnO,Cu2O և այլն:
Հիմնային են կոչվում այն օքսիդները, որոնց համապատասխանող հիդրատները հիմքեր են:
Na2O⇒NaOH,CaO⇒Ca(OH)2
Եթե օքսիդ առաջացնող տարրը ալկալիական կամ հողալկալիական մետաղ է կամ այլ մետաղ է, որը ցուցաբերում է այդ օքսիդում նվազագույն վալենտականություն (I,II),ապա օքսիդը որպես կանոն հիմնային է:
նատրիումի օքսիդ՝ Na2O կալցիումի օքսիդ՝ CaO
պղնձի (II) օքսիդ՝ CuO պղնձի (I) օքսիդ՝ Cu2O
երկաթի (II) օքսիդ՝ FeO մանգանի (II) օքսիդ՝ MnO
Հիմքերը բարդ նյութեր են, որոնք կազմված են մետաղի ատոմներից և մեկ կամ մի քանի հիդրոքսոներից՝ OH խմբից:
Լուծելի հիմքերը անվանվում են ալկալիներ:
Անլուծելի օքսիդների և նրանց համապատասխան հիմքերի միջև կապ հաստատվում է քայքայման ռեակցիայով: Տաքացնելիս այդ հիմքերը քայքայվում են՝ առաջացնելով համապատասխան օքսիդը:
Օրինակ՝ Mg(OH)2→t°MgO+H2O2Al(OH)3→t°Al2O3+3H2O
| Հիմնային օքսիդի բանաձևը և անվանումը | Լուծելի հիմքի ալկալու բանաձևը և անվանումը |
| Na2O` նատրիումի օքսիդ | NaOH` նատրիումի հիդրօքսիդ |
| K2O՝ կալիումի օքսիդ | KOH` կալիումի հիդրօքսիդ |
| Li2O` լիթիումի օքսիդ | LiOH՝ լիթիումի հիդրօքսիդ |
| Cs2O՝ ցեզիումի օքսիդ | CsOH՝ ցեզիումի հիդրօքսիդ |
| CaO՝ կալցիումի օքսիդ | Ca(OH)2՝ կալցիումի հիդրօքսիդ |
| SrO՝ ստրոնցիումի օքսիդ | Sr(OH)2՝ ստրոնցիումի հիդրօքսիդ |
| BaO՝ բարիումի օքսիդ | Ba(OH)2՝ բարիումի հիդրօքսիդ |
